Dary przyrody – występujące w roślinach hydroksylaktony terpenoidowe
The gifts of nature - terpenoid hydroxylactones found in plants
Małgorzata Grabarczyk
Katedra Chemii, Uniwersytet Przyrodniczy We Wrocławiu, ul. Norwida 25/27, 50-375 Wrocław, tel. 71 320 52 52,
Abstrakt: Związki zawierające w swojej strukturze pierścień laktonowy oraz grupę hydroksylową występują w wielu egzotycznych roślinach. Z obecnością hydroksylaktonów wiążą się właściwości lecznicze roślin, które medycyna ludowa wykorzystuje od dawna. W artykule zaprezentowano szereg hydroksylaktonów wykazujących różnorodną aktywność biologiczną: przeciwnowotworową, przeciwgrzybiczną, przeciwzapalną, przeciwreumatyczną. Laktony wykorzystywane w medycynie ludowej są alternatywą dla obecnie stosowanych preparatów leczniczych.
Słowa kluczowe: hydroksylaktony terpenoidowe, rośliny lecznicze, aktywność biologiczna
Abstract: Compounds containing in their structure a lactone ring and a hydroxy group occur in many exotic plants. With the presence of hydroxylactones are associate medicinal properties of plants, use in folk medicine for a long time. The article presents a number of hydroxylactones exhibiting different biological activities: anticancer, antifungal, anti-inflammatory, antirheumatic. These lactones used in folk medicine are an alternative to the currently used medicinal preparations.
Keywords: terpenoids hydroxylactones, medicinal plants, biological activity
Wstęp
Świat wokół nas rozwija się coraz szybciej, przy okazji zmuszając nas do sprostania coraz to nowym wyzwaniom. Żyjemy w coraz większym pośpiechu, mamy coraz mniej czasu na dbanie o zdrowie i dobre samopoczucie. Postęp nauki umożliwia syntezę nowych związków o różnorodnej aktywności biologicznej, ale wirusy i bakterie również ewoluują, nabywając oporności na stosowane leki. Poszukiwania nowych leków na różnego rodzaju schorzenia oznaczają coraz więcej syntetycznych związków wprowadzanych do naszych organizmów, a związki te powodują czasami działania niepożądane.
Potwierdzono, że rośliny wykorzystywane w medycynie ludowej wielu różnych rejonów świata, często zawierają w swoim składzie hydroksylaktony. Występują one wśród prostych strukturalnie monoterpenoidów i seskwiterpenoidów jak również di- i triterpenoidów o bardziej skomplikowanej strukturze. Związki te wykazują różnorodną aktywność biologiczną: przeciwnowotworową [1-4], przeciwzapalną [5-6], przeciwgrzybiczną [7-11, 20], przeciwreumatyczną [13-18], przeciwbakteryjną [19-21], co powoduje duże zainteresowanie naukowców.
Laktony o właściwościach cytotoksycznych
W procesie ewolucji, rośliny wyprodukowały substancje służące im do ochrony przed słońcem. Umożliwia im to naturalną ochronę przed bezpośrednim i intensywnym promieniowaniem ultrafioletowym (UV). Stanowiło to zachętę dla naukowców do podjęcia badań nad pigmentami pochodzenia roślinnego, służącymi do ochrony skóry przed poparzeniami słonecznymi. Przetestowano m.in. etanolowy wyciąg z korzeni, łodyg i kwiatostanów dzikiej cykorii Cichorium endivia subsp. divaricatum. Wykazano, że seskwiterpen 8-deoksylaktucyna 1 wyizolowany z korzeni Cichorium endivia pochłania promieniowanie z zakresu UVB i częściowo zapobiega powstawaniu dimerów pirymidyny i IL-6 mRNA w ludzkiej linii komórkowej keratynocytów, HaCaT. Zastosowanie wyciągu z korzenia na skórę całkowicie zapobiega rumieniowi wywoływanemu przez promieniowanie UVB [1]. Związki te mogą stanowić alternatywę dla konwencjonalnych filtrów przeciwsłonecznych.

Rys. 1. Lakton z korzeni dzikiej cykorii Cichorium endivia subsp. divaricatum
Subwellerolaktony A (2), B (3), D (4) oraz E (5) wyizolowano z grzybów Lactarius subvellerus rosnących w Chinach i Korei. Stwierdzono, że związki 3-5 wykazują aktywność przeciwnowotworową wobec linii komórkowych A549 (niedrobnokomórkowy rak płuca) i HCT-15 (gruczolakorak jelita grubego), a związek 3 również w stosunku do linii komórkowej SK-MEL-2 (czerniak) [2, 3].

Rys. 2. Laktony wyizolowane z grzybów Lactarius subvellerus
W Chinach występuje ponad 110 gatunków roślin z rodzaju Ligularia (Asteraceae), z czego około 40 wykorzystywanych jest w tradycyjnej medycynie. Zioła te mają działanie przeciwnowotworowe, przeciwbakteryjne i przeciwzapalne.
Z odmiany Ligularia platyglossa wyizolowano, m.in. pochodne eremofilolidowe 6 i 7 oraz eudesmanolid 8. Przeprowadzone testy potwierdziły, że eremofilolidy wykazują aktywność przeciwnotworową wobec linii komórkowych raka HL-60 (białaczka promielocytowa). Związek 7 cechuje się aktywnością cytotoksyczną wobec linii komórkowych B-16 (czerniak) i Hela (rak komórek nabłonkowych) [4].

Rys. 3. Laktony wyizolowane z Ligularia platyglossa
Laktony o właściwościach przeciwzapalnych
Z liści i gałęzi rośliny z gatunku Rolandra fruticosa, występującej w Ameryce Północnej, wyizolowano kilka laktonów seskwiterpenoidowych 9-11. Ekstrakty stosuje się w medycynie ludowej do leczenia zapalenia stawów, cukrzycy, obrzęków związanych z HIV i malarią. Były one wykorzystywane również w niektórych obrzędach religijnych przez rdzenną ludność Kolumbii i Panamy [5].

Rys. 4. Laktony wyizolowane z Rolandra fruticosa
W Brazylii często spotykana jest roślina Vernonia scorpioides rosnąca na ubogich, wylesionych, neotropikalnych glebach. Z jej świeżych liści i kwiatów wyizolowano m.in. laktony seskwiterpenoidowe: glaukolid 12 i hirsutynolid 13. Ekstrakty alkoholowe są stosowane przez miejscową ludność do leczenia przewlekłych ran i owrzodzeń [6].

Rys. 5. Laktony wyizolowane z Vernonia scorpioides
Laktony o właściwościach przeciwgrzybicznych
Ludność Gujany Francuskiej wykorzystuje jako materiał budowlany drewno z drzew z rodzaju Sextonia rubra odporne na procesy gnilne i próchnicze. Stwierdzono, że ekstrakty z drewna – bieli i twardzieli wykazują aktywność przeciwgrzybiczą wobec grzybów Pycnoporus sanguineus oraz Gloeophyllum trabeum. Za tę aktywność odpowiedzialne są laktony monoterpenoidowe: rubrenolid 14 i rubrynolid 15. Dodatkowe testy potwierdziły ich właściwości przeciwgrzybicze również wobec grzybów patogenicznych: Microsporum gypseum, Microsporum canis, Tricophyton rubrum, Tricophyton mentagrophytes, Candida albicans, Candida glabtrata, Candida krusei oraz cytotoksyczność wobec komórek fibroblastów NIH-3T3 ssaków [7].

Rys. 6. Laktony wyizolowane z drzew Sextonia rubra
Z nadziemnych części indyjskiej rośliny Artemisia pallens wyizolowano dwa laktony seskwiterpenowe z grupy germakranolidów: 5b-epoksy-10β-hydroksy-1-en-3-on-trans-germacran-6a,12-olid 16 oraz jego 10α-epimer 17 o działaniu przeciwbakteryjnym i przeciwgrzybicznym [8].

Rys. 7. Laktony wyizolowane z Artemisia pallens
Z występujących w Grecji roślin Centaurea thessala ssp. drakiensis oraz Centaurea attica ssp. attaca wyizolowano 8α-(3,4-butanoloksymetylen)-dehydro-melitensynę (18) o właściwościach grzybobójczych [9].
Z kolei w rosnącej dziko w Czarnogórze rośliny Centaurea nicolai znaleziono kandawanolid 19 i salograwiolid 20, które w znacznym stopniu hamowały wzrost szczepów grzybów: Aspergillus ochraceus, Cladosporium cladosporides, Penicilium ochrochloron, Fusarium tricinctum [10].
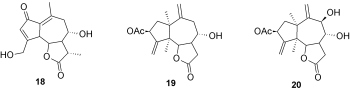
Rys. 8. Laktony wyizolowane z Centaurea thessala i Centaurea nicolai
Z rośliny Caesalpinia pulcherrima rosnącej w Tajlandii wyizolowano m.in. diterpenoidy: neocezalpinę P 21 i neocezalpinę R 22. Wywar z jej liści, kory i korzeni jest używany przez miejscową ludność w celu złagodzenia infekcji grzybiczej i obniżenia gorączki [11].

Rys. 9. Laktony wyizolowane z Caesalpinia pulcherrima
Laktony o właściwościach przeciwreumatycznych, przeciwbakteryjnych i innych
Monoterpenoidowy lakton loliolid 23 znaleziono w świeżych korzeniach Sonchus oleraceus L., rośliny występującej w Egipcie. Wykazywał on aktywność przeciwbakteryjną wobec szczepów: B. Subtilis, E. coli, S. aureus oraz N. gonorrhoeae [12]. Lakton 23 występuje również w liściach filipińskiego krzewu Malachra fasciata, okłady z jego liści stosuje się w leczeniu wrzodów i ran. Korzenie i liście używane są w leczeniu reumatyzmu, gorączki, hemoroidów, impotencji i jako diuretyk [13].

Rys. 10. Lakton loliolid
Z chińskiej rośliny Buddleja asiatica wyizolowano monoterpenoidowy lakton buddlin 24. Korzenie, łodygi i liście tej rośliny wykorzystywane są w tradycyjnej medycynie chińskiej w leczeniu reumatyzmu, bóli stawów, gorączki i biegunki [14].

Rys. 11. Lakton wyizolowany z Buddleja asiatica
Z nadziemnych części rośliny Angiopteris esculenta wyizolowano monoterpenoidowe laktony 25-27. Rośliny z rodzaju Angiopteris są stosowane w tradycyjnej medycynie chińskiej w leczeniu bólów reumatycznych, stawów oraz po ukąszeniu przez węża [15].

Rys. 12. Laktony wyizolowane z Angiopteris esculenta
Z pochodzącej z Ameryki Północnej wieloletniej rośliny zielnej Anaphalis margaritacea (Zachodnia Perła Młodości) wyizolowano monoterpenoidy 28 i 29. Wyciągi z tej rośliny były powszechnie stosowane przez wiele rdzennych plemion amerykańskich jako lekarstwo na reumatyzm, przeziębienie, kaszel i duszności [16].

Rys. 13. Laktony wyizolowane z Anaphalis margaritacea
Wiele roślin z rodzaju Chloranthus wykorzystywanych jest szeroko w medycynie ludowej do leczenia bóli reumatycznych, urazów, złamań, gruźlicy płuc i neurastenii. Z wieloletniej rośliny zielnej Chloranthus japonicus wyizolowano m.in. seskwiterpeny typu lindenanu: chlorajapolidy 30-34 oraz seskwiterpen typu eudesmanu chloraeudolid 35 [17].

Rys. 14. Laktony wyizolowane z Chloranthus japonicus
Kora pnia drzewa Albizia versicolor, zawierająca diterpenoid 36, jest używana w Kenii w leczeniu bólu stawów, gorączki, kaszlu, chorób wenerycznych, oraz zakażeń tasiemcem. Z kolei kora Albizia schimperana jest stosowana w uśmierzaniu bólu, leczeniu malarii oraz złym samopoczuciu [18].

Rys. 15. Lakton wyizolowany z drzew Albizia versicolor oraz Albizia schimperana
Występująca w Ameryce Południowej roślina Cyrtocymura cincta biosyntezuje, m.in. dwa gojazenzolidy 37, 38, które chronią ją przed owadami roślinożernymi. Dodatkowo laktony 37 i 38 wykazują działanie przeciwbakteryjne wobec szczepów bakterii Gram-dodatnich Staphylococcus aureus, S. aureus, Lactobacillus paracasei ssp. Paracasei oraz Enterococcus faecalis [19].

Rys. 16. Laktony wyizolowane z Cyrtocymura cincta
W południowo-zachodniej Europie i Afryce północnej występuje dwuletnia roślina Centaurea pullata L. znana ze swojego działania przeciwbakteryjnego, cytotoksycznego, przeciwgrzybicznego i antyfidantnego. Z jej nadziemnych części wyizolowano kilka laktonów 39-42 wykazujących silne działanie bakteriobójcze wobec szczepów Gram-ujemnych bakterii: Escherichia coli, Pseudomonas tolaasii, Salmonella enteritidis oraz wobec Gram-dodatnich: Bacillus subtilis, Micrococcus flavus oraz Staphylococcus epidermidis. Laktony te wykazują również działanie przeciwgrzybicze wobec: Alternaria alternata, Aspergillus flavus, Aspergillus niger, Aspergillus ochraceus, Fusarium tricinctum, Penicillium funiculosum, Penicillium ochrochloron oraz Trichoderma viride [20].

Rys. 17. Laktony wyizolowane z Centaurea pullata L.
Glony Vaucheria sessilis, występujące w rzece Balsas - Meksyk, wytwarzają lakton 43, wykazujący działanie bakteriobójcze wobec szczepów: Bacillus subtilis, Bacillus cereus. Staphylococcus aureus, Staphylococcus epidermidis oraz Escherichia coli [21].

Rys. 18. Lakton wyizolowany z Vaucheria sessilis.
Podsumowanie
Hydroksylaktony są to związki występujące w świecie roślin egzotycznych Afryki, Azji i obu Ameryk. Wykazują one różnorodną aktywność biologiczną: cytotoksyczną, przeciwzapalną, przeciwgrzybiczą, przeciwreumatyczną lub przeciwbakteryjną. Dlatego też są stosowane w medycynie ludowej i stanowią alternatywę dla obecnie stosowanych leków syntetycznych.
Literatura:
1. C.D. Enk, M. Hochberg, A. Torres, O. Lev, I. Dor, M. Srebnik, V.M. Dembitsky, Photoprotection by Cichorium endivia Extracts: Prevention of UVB-Induced Erythema, Pyrimidine Dimer Formation and IL-6 Expression, Skin Pharmacology Physiology; vol. 17, 2004, s. 42-48.
2. Z. Jing, Z.F. Xiao: Sesquiterpene hydroxylactone from Lactarius subvellereus, Phytochemistry, vol. 44, 1997, s. 157-159.
3. K.H. Kim, H.J. Noh, S.U. Choi, K.M. Park, S.J. Seok, K.R. Lee: Lactarane sesquiterpenoids from Lactarius subvellereus and their cytotoxicity, Bioorganic & Medicinal Chemistry Letters, vol. 20, 2010, s. 5385-5388.
4. J.Q. Liu, M. Zhang, C.F. Zhang, H.Y. Qi, A. Bashall, S.W.A. Bligh, Z.T. Wang: Cytotoxic sesquiterpenes from Ligularia platyglossa, Phytochemistry, vol. 69, 2008, s. 2231–2236.
5. L. Pan, D.D. Lantvit, S. Riswan, L.B.S. Kardono, H.B. Chai, E.J.C. de Blanco, N.R. Farnsworth, D.D. Soejarto, S.M. Swanson, A.D. Kinghorn: Bioactivity-guided isolation of cytotoxic sesquiterpenes of Rolandra fruticosa, Phytochemistry, vol. 71, 2010, s. 635–640.
6. H. Buskuhl, F.L. de Oliveira, L.Z. Blind, R.A. de Freitas, A. Barison, F.R. Campos, Y.E. Corilo, M.N. Eberlin, G.F. Caramori, M.W. Biavatti: Sesquiterpene lactones from Vernonia scorpioides and their in vitro cytotoxicity, Phytochemistry, vol. 71, 2010, s. 1539–1544.
7. A.M.S. Rodrigues, P.N.E.T. Theodoro, V. Eparvier, C. Basset, M.R.R. Silva, J. Beauchne, L.S. Espindola, D. Stien: Search for Antifungal Compounds from the Wood of Durable Tropical Trees, Journal of Natural Products, vol. 73, 2010, s. 1706–1707.
8. P.P. Pujar, D.D. Sawaikar, S.R. Rojatkar, B.A. Nagasampagi: A new germacranolide from Artemisia pallens, Fitoterapia, vol. 71, 2000, s. 590-592.
9. H. Skaltsa, D. Lazari, C. Panagouleas, E. Georgiadou, B. Garcia, M. Sokovic: Sesquiterpene lactones from Centaurea thessala and Centaurea attica. Antifungal activity, Phytochemistry, vol 55, 2000, s. 903-908.
10. V. Vajs, N. Todorovic, M. Ristic: Guaianolides from Centaurea nicolai: antifungal activity, Phytochemistry, vol. 52, 1999, s. 383-386.
11. W. Pranithanchai, C. Karalai, C. Ponglimanont, S. Subhadhirasakul, K. Chantrapromma: Cassane diterpenoids from the stem of Caesalpinia pulcherrima, Phytochemistry, vol. 70, 2009, s. 300–304.
12. E.S. Elkhayat: Cytotoxic and Antibacterial Constituents from the Roots of Sonchus oleraceus L. Growing in Egypt, Pharmacognosy Magazine, vol. 5, 2009, s. 324-328.
13. C.Y. Ragasa, V. Agbayani, R.B. Hernandez, J.A. Rideout: Antimutagenic monoterpene from Malachra fasciata (Malvaciae), Philippine Journal of Science, vol. 126, 1997, s. 183-189.
14. H. Chen, C. Xu, D.Q. Liu, S.Q. An, R.X. Tan: Buddlin, a new compound from Buddleja asiatica, Fitoterapia, vol. 76, 2005, s. 588–589.
15. Y. Chen, Y. Tao, X. Lian, L. Wang, Y. Zhao, J. Jiang, Y. Zhang: Chemical constituents of Angiopteris esculenta including two new natural lactones, Food Chemistry, vol. 122, 2010, s. 1173–1175.
16. A. Ahmed, T.A. Hussein, A.A. Mahmoud, M.A. Farag, P.W. Pare, M. Wojcińska, J. Karchesy, T.J. Mabry: Nor-ent-kaurane diterpenes and hydroxylactones from Antennaria geyeri and Anaphalis margaritacea, Phytochemistry, vol. 65, 2004, s. 2539-2543.
17. Q.H. Wang, H.X. Kuang, B.Y. Yang, Y.G. Xia, J.S. Wang, L.Y. Kong: Sesquiterpenes from Chloranthus japonicus, Journal of Natural Products, vol. 74 (1), 2011, s. 16–20
18. G.M. Rukunga, P.G. Waterman: Triterpenes of Albizia versicolor and Albizia schimperana stem barks, Fitoterapia, vol. 72, 2001, s. 188-190.
19. E. Cartagena, S. Montanaro, A. Bardón: Improvement of The Antibacterial Activity of Sesquiterpene Lactones, Revista Latinoamericana de Química, vol. 36, 2008, s. 43-51.
20. S. Djeddi, A. Karioti, M. Sokovic, C. Koukoulitsa, H. Skaltsa: A novel sesquiterpene lactone from Centaurea pullata: Structure elucidation, antimicrobial activity, and prediction of pharmacokinetic properties, Bioorganic & Medicinal Chemistry, vol. 16, 2008, s. 3725–3731.
21. R.M. Pérez Gutiérrez: An antibacterial sesquiterpene lactone from fresh-water alga Vaucheria sessilis, Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, vol. 8, 2009, s. 289–294.
Ilustracje zamieszczone w tekście pochodzą z następujących stron:
http://www.flickr.com/photos/23630893@N08/2975531692/
http://www.florafinder.com/LargePhotos/DE/Anaphalis_margaritacea-A15AA4496E.jpg
 Małgorzata Grabarczyk - dr nauk chemicznych w zakresie chemii.
Małgorzata Grabarczyk - dr nauk chemicznych w zakresie chemii.
W latach 1984-1989 studiowała chemię na Wydziale Matematyki, Fizyki i Chemii Uniwersytetu Wrocławskiego. Od 1995 roku pracuję w Katedrze Chemii Uniwersytetu Przyrodniczego we Wrocławiu. W 2003 roku obroniła pracę doktorską w dziedzinie chemii organicznej na Wydziale Chemii Uniwersytetu Wrocławskiego.
W pracy badawczej zajmuje się syntezą laktonów terpenoidowych (głównie chlorowco- i hydroksypochodnych) z układem metylo-, dimetylo- i trimetylocykloheksanu oraz biotransformacjami chlorowcolaktonów przy użyciu grzybów strzępkowych (głównie z rodzaju Fusarium).






Komentarze obsługiwane przez CComment